Химия 11 класс (Урок№6 - Дисперсные системы.)
Химия 11 класс
Урок№6 - Дисперсные системы.
Некоторые вещества, например, поваренная соль или сахар, хорошо растворяются в воде, образуя однородную систему. А другие вещества, например, измельчённый мел, крахмал при смешивании с водой не растворяются полностью, образуют гетерогенную систему. Почему так происходит?
мы узнаем:
какие растворы называются истинными;
классификацию, состав и свойства дисперсных систем;
мы научимся:
вычислять концентрацию растворов;
мы сможем:
описать свойства дисперсных систем, объяснить причины коагуляции золей.
Истинными растворами называются гомогенные системы, состав которых можно изменять в определённых пределах без нарушения однородности. Концентрацию раствора можно выражать в массовой доле и в молях на литр раствора (молярная концентрация).
Дисперсной системой называют гетерогенную систему, состоящую из двух или более фаз, в которой одна фаза мелко раздроблена и равномерно распределена в другой, сплошной фазе. Дисперсные системы различаются по размерам частиц дисперсной фазы, они рассеивают свет, а в постоянном электрическом поле коллоидные частицы движутся к одному из электродов. Слипание коллоидных частиц в результате нагревания, добавления электролита называется коагуляцией.
Аэрозоль – грубодисперсная система, в которой твёрдые или жидкие частицы размером более 10–3 см равномерно распределены в газообразной среде.
Гель – полутвёрдая трёхмерная ячеистая структура, каркас которой образован коллоидными частицами, а в прослойках между частицами удерживается дисперсионная среда.
Грубодисперсная система – дисперсная система, в которой размер частиц дисперсной фазы более 10–3 см.
Дисперсионная среда – сплошная фаза, составная часть дисперсной системы, в которой равномерно распределены частицы дисперсной фазы.
Дисперсная система – гетерогенная система, состоящая, как минимум, из двух фаз, одна из которых мелко раздроблена и равномерно распределена в другой, сплошной фазе.
Дисперсная фаза – мелко раздробленные частицы, равномерно распределённые в дисперсионной среде.
Гетерогенная система – неоднородная система, в которой компоненты находятся в разных фазах и между ними существует видимая граница раздела фаз.
Гомогенная система – однородная система, все компоненты которой находятся в одной фазе, граница раздела фаз между компонентами отсутствует.
Золь (коллоидный раствор) – тонкодисперсная система, в которой твёрдые частицы дисперсной фазы размером 10–7 – 10–5 см равномерно распределены в жидкой среде.
Истинный раствор – гомогенная система, состоящая из двух или более компонентов, состав которой в определённых пределах можно изменять без нарушения однородности.
Коагуляция – процесс слипания коллоидных частиц в более крупные агрегаты.
Опалесценция – изменение окраски бесцветного коллоидного раствора с желтоватой в проходящем свете на голубую в отраженном свете.
Седиментация – процесс оседания крупных частиц дисперсной фазы.
Суспензия – грубодисперсная система, в которой твёрдые частицы размером более 10–3 см равномерно распределены в жидкой дисперсионной среде.
Фаза – часть системы, однородная по составу и свойствам, отделённая от окружающей среды видимой границей раздела.
Электрофорез – движение коллоидных частиц золя в постоянном электрическом поле к одному из электродов.
Эмульсия – грубодисперсная система, в которой одна жидкая фаза в виде отдельных мелких капель равномерно распределена в другой жидкости, при этом жидкости взаимно нерастворимы.
Эффект Тиндаля – образование светлого конуса в отраженном свете при прохождении через дисперсную систему луча света.
Видео Химия 11 класс (Урок№6 - Дисперсные системы.) канала LiameloN School
Урок№6 - Дисперсные системы.
Некоторые вещества, например, поваренная соль или сахар, хорошо растворяются в воде, образуя однородную систему. А другие вещества, например, измельчённый мел, крахмал при смешивании с водой не растворяются полностью, образуют гетерогенную систему. Почему так происходит?
мы узнаем:
какие растворы называются истинными;
классификацию, состав и свойства дисперсных систем;
мы научимся:
вычислять концентрацию растворов;
мы сможем:
описать свойства дисперсных систем, объяснить причины коагуляции золей.
Истинными растворами называются гомогенные системы, состав которых можно изменять в определённых пределах без нарушения однородности. Концентрацию раствора можно выражать в массовой доле и в молях на литр раствора (молярная концентрация).
Дисперсной системой называют гетерогенную систему, состоящую из двух или более фаз, в которой одна фаза мелко раздроблена и равномерно распределена в другой, сплошной фазе. Дисперсные системы различаются по размерам частиц дисперсной фазы, они рассеивают свет, а в постоянном электрическом поле коллоидные частицы движутся к одному из электродов. Слипание коллоидных частиц в результате нагревания, добавления электролита называется коагуляцией.
Аэрозоль – грубодисперсная система, в которой твёрдые или жидкие частицы размером более 10–3 см равномерно распределены в газообразной среде.
Гель – полутвёрдая трёхмерная ячеистая структура, каркас которой образован коллоидными частицами, а в прослойках между частицами удерживается дисперсионная среда.
Грубодисперсная система – дисперсная система, в которой размер частиц дисперсной фазы более 10–3 см.
Дисперсионная среда – сплошная фаза, составная часть дисперсной системы, в которой равномерно распределены частицы дисперсной фазы.
Дисперсная система – гетерогенная система, состоящая, как минимум, из двух фаз, одна из которых мелко раздроблена и равномерно распределена в другой, сплошной фазе.
Дисперсная фаза – мелко раздробленные частицы, равномерно распределённые в дисперсионной среде.
Гетерогенная система – неоднородная система, в которой компоненты находятся в разных фазах и между ними существует видимая граница раздела фаз.
Гомогенная система – однородная система, все компоненты которой находятся в одной фазе, граница раздела фаз между компонентами отсутствует.
Золь (коллоидный раствор) – тонкодисперсная система, в которой твёрдые частицы дисперсной фазы размером 10–7 – 10–5 см равномерно распределены в жидкой среде.
Истинный раствор – гомогенная система, состоящая из двух или более компонентов, состав которой в определённых пределах можно изменять без нарушения однородности.
Коагуляция – процесс слипания коллоидных частиц в более крупные агрегаты.
Опалесценция – изменение окраски бесцветного коллоидного раствора с желтоватой в проходящем свете на голубую в отраженном свете.
Седиментация – процесс оседания крупных частиц дисперсной фазы.
Суспензия – грубодисперсная система, в которой твёрдые частицы размером более 10–3 см равномерно распределены в жидкой дисперсионной среде.
Фаза – часть системы, однородная по составу и свойствам, отделённая от окружающей среды видимой границей раздела.
Электрофорез – движение коллоидных частиц золя в постоянном электрическом поле к одному из электродов.
Эмульсия – грубодисперсная система, в которой одна жидкая фаза в виде отдельных мелких капель равномерно распределена в другой жидкости, при этом жидкости взаимно нерастворимы.
Эффект Тиндаля – образование светлого конуса в отраженном свете при прохождении через дисперсную систему луча света.
Видео Химия 11 класс (Урок№6 - Дисперсные системы.) канала LiameloN School
Показать
Комментарии отсутствуют
Информация о видео
Другие видео канала
 Дисперсные системы | Химия 11 класс #11 | Инфоурок
Дисперсные системы | Химия 11 класс #11 | Инфоурок Коллоидные растворы. Дисперсные системы
Коллоидные растворы. Дисперсные системы Дисперсные системы (образование, свойства и устойчивость коллоидных растворов)
Дисперсные системы (образование, свойства и устойчивость коллоидных растворов) Мицелла
Мицелла Что такое коллоидные частицы. Понятие коллоидов. Коллоидные растворы.
Что такое коллоидные частицы. Понятие коллоидов. Коллоидные растворы. Коллоидная химия. Лекция 1. Физико-химия поверхностных явлений
Коллоидная химия. Лекция 1. Физико-химия поверхностных явлений Схема строения мицеллы
Схема строения мицеллы Коагуляция золя
Коагуляция золя Суспензии, коллоиды и растворы
Суспензии, коллоиды и растворы Получение коллоидных растворов
Получение коллоидных растворов Гетерогенная реакция в аппарате Киппа
Гетерогенная реакция в аппарате Киппа Дисперсные системы.
Дисперсные системы. Химия. Углерод
Химия. Углерод Видеоурок по химии "Дисперсные системы"
Видеоурок по химии "Дисперсные системы"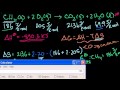 Пример свободной энергии Гиббса
Пример свободной энергии Гиббса 10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химии
10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химии
 8 класс Растворение веществ в воде
8 класс Растворение веществ в воде Физика 11 класс (Урок№25 - Квантовые постулаты Бора.)
Физика 11 класс (Урок№25 - Квантовые постулаты Бора.) Химия. Дисперсные системы
Химия. Дисперсные системы