Гальванический элемент
Разберем устройство простейшей батареи, гальванического элемента.
Нальем стакан электролит, например кислоту.
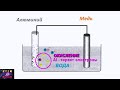
Гальванический элемент состоит из двух электродов.
Пусть это будут две пластины.
Одним электродом служит уголь, другим - цинк.
Погрузим частично электроды в электролит.
Кислота постепенно растворяет цинковый электрод, в нее переходит положительные ионы цинка, а сам цинковый электрод заряжается отрицательно.
По мере перехода ионов цинка в кислоту, электролит заряжается положительно.
В результате этого и некоторых химических реакций, электроны стекает с угольного электрода и он также заряжается положительно.
Отрицательно заряженный электрод называется катодом, а положительно заряженный - анодом.
Между катодом и анодом возникает разность потенциалов.
После того как цинковый электрод зарядился отрицательно, к нему начинают притягиваться положительные ионы из электролита.
Устанавливается равновесие.
Число ионов, покидающих катод за некоторый промежуток времени, становится равным числу ионов, осаждающихся на нём за этот же промежуток времени.
Разность потенциалов между электродами остается постоянной.
Соединим электроды проводником.
Мы видим, что по нему идет ток.
Растворение цинка усиливается.
Происходит также постепенное разрушение угольного электрода.
Видео Гальванический элемент канала ШКОЛА ОНЛАЙН
Нальем стакан электролит, например кислоту.
Гальванический элемент состоит из двух электродов.
Пусть это будут две пластины.
Одним электродом служит уголь, другим - цинк.
Погрузим частично электроды в электролит.
Кислота постепенно растворяет цинковый электрод, в нее переходит положительные ионы цинка, а сам цинковый электрод заряжается отрицательно.
По мере перехода ионов цинка в кислоту, электролит заряжается положительно.
В результате этого и некоторых химических реакций, электроны стекает с угольного электрода и он также заряжается положительно.
Отрицательно заряженный электрод называется катодом, а положительно заряженный - анодом.
Между катодом и анодом возникает разность потенциалов.
После того как цинковый электрод зарядился отрицательно, к нему начинают притягиваться положительные ионы из электролита.
Устанавливается равновесие.
Число ионов, покидающих катод за некоторый промежуток времени, становится равным числу ионов, осаждающихся на нём за этот же промежуток времени.
Разность потенциалов между электродами остается постоянной.
Соединим электроды проводником.
Мы видим, что по нему идет ток.
Растворение цинка усиливается.
Происходит также постепенное разрушение угольного электрода.
Видео Гальванический элемент канала ШКОЛА ОНЛАЙН
Показать
Комментарии отсутствуют
Информация о видео
Другие видео канала
 Гальванический элемент
Гальванический элемент
 Почему нельзя соединять медь и алюминий
Почему нельзя соединять медь и алюминий БОЛЬШОЙ ПРОРЫВ! ГРАФЕНОВЫЕ БАТАРЕИ УЖЕ НА РЫНКЕ
БОЛЬШОЙ ПРОРЫВ! ГРАФЕНОВЫЕ БАТАРЕИ УЖЕ НА РЫНКЕ Победа! Гальванический трансформатор сделал!
Победа! Гальванический трансформатор сделал! Гальванические элементы
Гальванические элементы Реально ли Сделать БАТАРЕЙКУ ИЗ ГРЯЗИ?
Реально ли Сделать БАТАРЕЙКУ ИЗ ГРЯЗИ? Электрохимия. Гальванический элемент Даниэля-Якоби
Электрохимия. Гальванический элемент Даниэля-Якоби Гальванический элемент
Гальванический элемент 🌑 ДЖОУЛЬ ВОР в ОДНОЙ ДЕТАЛИ Микросхема YX805 и её возможности.
🌑 ДЖОУЛЬ ВОР в ОДНОЙ ДЕТАЛИ Микросхема YX805 и её возможности. Гальванический элемент
Гальванический элемент Школа бокса. Скакалка. От азов до первых трюков. Серия 6.
Школа бокса. Скакалка. От азов до первых трюков. Серия 6. Медно-купоросный элемент Калло
Медно-купоросный элемент Калло Батарейка на воде, вечная батарейка своими руками 9v DIY
Батарейка на воде, вечная батарейка своими руками 9v DIY Cобрать ТЕРМОЯДЕРНЫЙ РЕАКТОР у себя дома?
Cобрать ТЕРМОЯДЕРНЫЙ РЕАКТОР у себя дома? Общее устройство легкового автомобиля в 3D. Как работает автомобиль?
Общее устройство легкового автомобиля в 3D. Как работает автомобиль? Как отличить метанол от этанола, народные методы
Как отличить метанол от этанола, народные методы Генератор
Генератор Устройство и принцип работы автомобильного аккумулятора. Схема аккумулятора.
Устройство и принцип работы автомобильного аккумулятора. Схема аккумулятора. ТОПЛИВНЫЙ ЭЛЕМЕНТ 0,7вольт 1300мА!!!
ТОПЛИВНЫЙ ЭЛЕМЕНТ 0,7вольт 1300мА!!!